Problemas de Boyle-Mariotte
El comportamiento de un gas depende de su relación entre el volumen, la presión y la temperatura. Esta relación fue experimentada por científicos que enunciaron leyes o principios conocidos como su nombre lo indica: Ley de Boyle-Mariotte , donde el enunciado de dicho experimento nos advierte:
Si la temperatura permanece constante, el volumen de una masa gaseosa es inversamente proporcional a la presión que se le aplica.
Para estudiar los cambios que experimenta un gas, comúnmente se consideran los estados inicial y final, por lo que la expresión matemática para la Ley de Boyle - Mariotte es:
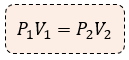
Donde:
P1 = presión inicial
P2 = volumen inicial
V1 = presión final
V2 = volumen final
👉 Si la presión aumenta, el volumen disminuye y si la presión disminuye el volumen aumenta.
📈 Gráfica de Presión vs Volumen
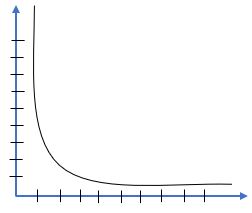
Gráficamente podemos representar el volumen y la presión, en cantidades que son inversamente proporcionales.
📃 Ejercicios Resueltos de La Ley de Boyle - Mariotte
Para aprender mucho mejor el tema, veamos algunos ejercicios resueltos:
Solución:
Si algo tienen los problemas de Boyle-Mariotte es que siempre estarán en proceso isotérmico, es decir a temperatura constante. Ahora vamos a a resolver el problema colocando datos:
V1 = 3.5 L
P1 = 760 mm de Hg
P2 = 380 mm de Hg
V2 = ?
Ahora anotemos en cuaderno o en cualquier lado la ecuación de Boyle-Mariotte.
$\displaystyle {{P}_{1}}{{V}_{1}}={{P}_{2}}{{V}_{2}}$
Despejemos la incógnita de nuestro problema que bien sabemos que es ” V2 ”
$\displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{P}_{2}}}$
Ahora sustituimos nuestros datos en la ecuación.
$\displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{P}_{2}}}=\frac{\left( 760mmdeHg \right)\left( 3.5l \right)}{380mmdeHg}=7l$
Respuesta:
Por lo que obtenemos, un volumen final de 7 litros
Solución:
Bien, el problema de nueva cuenta es fácil, no hay dificultad más que aplicar lo de sustitución de datos en fórmula y listo…
V1 = 1.5 L
P1 =2.5 atm
V2 = 3 L
P2 = ?
Despejemos la incógnita de nuestro problema que bien sabemos que es ” P2 ”
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{V}_{2}}}$
Ahora sustituimos nuestros datos en la ecuación.
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{V}_{2}}}=\frac{\left( 2.5atm \right)\left( 1.5l \right)}{3l}=1.25atm$
Sin embargo, en el ejercicio se nos pide la respuesta expresada en milímetros de mercurio (Hg), por lo que aplicamos una regla de 3 para la conversión:
1 atm = 760 mm de Hg
1.25 atm = x
aplicamos
$\displaystyle x=\frac{{(760mmdeHg)(1.25atm)}}{{1atm}}=950mmdeHg$
Por lo que nuestra respuesta es: 950 mm de Hg
Respuesta:
Por lo que la presión final es de 950 mm de Hg
Solución:
Este problema se resuelve aplicando la Ley de Charles, que relaciona el volumen y la temperatura a presión constante. Primero, identificamos nuestros datos iniciales y finales.
V1 = 800 ml
T1 = 27 °C
V2 = ?
T2 = 127 °C
Para usar las fórmulas de los gases, es obligatorio convertir las temperaturas a Kelvin (K).
K = °C + 273
T1 = 27 + 273 = 300 K
T2 = 127 + 273 = 400 K
La fórmula de la Ley de Charles es:
$\displaystyle \frac{{{V}_{1}}}{{{T}_{1}}}=\frac{{{V}_{2}}}{{{T}_{2}}}$
Despejamos la incógnita, que es V2:
$\displaystyle {{V}_{2}}=\frac{{{V}_{1}}{{T}_{2}}}{{{T}_{1}}}$
Sustituimos los valores en la ecuación:
$\displaystyle {{V}_{2}}=\frac{\left( 800ml \right)\left( 400K \right)}{300K}=1066.67ml$
El problema pide el resultado en litros, así que convertimos los mililitros:
1 L = 1000 ml
$\displaystyle V2=\frac{1066.67ml}{1000} = 1.067 L$
Respuesta:
El volumen final del gas será de 1.067 L.
Solución:
Este caso corresponde a la Ley de Gay-Lussac, que describe la relación entre la presión y la temperatura a volumen constante.
P1 = 3.2 atm
T1 = 20 °C
P2 = ?
T2 = 50 °C
Primero, convertimos las temperaturas a Kelvin:
T1 = 20 + 273 = 293 K
T2 = 50 + 273 = 323 K
La fórmula de la Ley de Gay-Lussac es:
$\displaystyle \frac{{{P}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}}{{{T}_{2}}}$
Despejamos nuestra incógnita P2:
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{T}_{2}}}{{{T}_{1}}}$
Ahora, sustituimos los datos:
$\displaystyle {{P}_{2}}=\frac{\left( 3.2atm \right)\left( 323K \right)}{293K}=3.52atm$
Respuesta:
La nueva presión dentro del neumático es de 3.52 atm.
Solución:
Aquí tenemos cambios en presión, temperatura y volumen, por lo que debemos usar la Ley Combinada de los Gases.
P1 = 1 atm
T1 = 0 °C
V1 = 22.4 L
P2 = 2.5 atm
T2 = 100 °C
V2 = ?
Convertimos las temperaturas a Kelvin:
T1 = 0 + 273 = 273 K
T2 = 100 + 273 = 373 K
La fórmula de la Ley Combinada es:
$\displaystyle \frac{{{P}_{1}}{{V}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}{{V}_{2}}}{{{T}_{2}}}$
Despejamos la incógnita V2:
$\displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}{{T}_{2}}}{{{T}_{2}}{{P}_{1}}}$
Sustituimos los valores en la ecuación:
$\displaystyle {{V}_{2}}=\frac{\left( 1atm \right)\left( 22.4L \right)\left( 373K \right)}{\left( 2.5atm \right)\left( 273K \right)}=12.23L$
Respuesta:
El nuevo volumen que ocupará el gas es de 12.23 L.
Solución:
Este es un problema clásico de la Ley de Boyle, que relaciona presión y volumen a temperatura constante.
V1 = 200 L
P1 = 740 mm de Hg
V2 = ?
P2 = 400 mm de Hg
La fórmula de la Ley de Boyle es:
$\displaystyle {{P}_{1}}{{V}_{1}}={{P}_{2}}{{V}_{2}}$
Despejamos el volumen final, V2:
$\displaystyle {{V}_{2}}=\frac{{{P}_{1}}{{V}_{1}}}{{{P}_{2}}}$
Sustituimos los datos conocidos:
$\displaystyle {{V}_{2}}=\frac{\left( 740mmdeHg \right)\left( 200L \right)}{400mmdeHg}=370L$
Como las unidades de presión son las mismas (mm de Hg), se cancelan y no es necesario convertirlas a atmósferas.
Respuesta:
El nuevo volumen del globo es de 370 L.
Solución:
Dado que el tanque es de acero, su volumen es rígido y constante. Por lo tanto, aplicamos la Ley de Gay-Lussac.
P1 = 12.0 atm
T1 = 27 °C
P2 = ?
T2 = 100 °C
Convertimos las temperaturas a la escala Kelvin:
T1 = 27 + 273 = 300 K
T2 = 100 + 273 = 373 K
La fórmula de Gay-Lussac es:
$\displaystyle \frac{{{P}_{1}}}{{{T}_{1}}}=\frac{{{P}_{2}}}{{{T}_{2}}}$
Despejamos la presión final, P2:
$\displaystyle {{P}_{2}}=\frac{{{P}_{1}}{{T}_{2}}}{{{T}_{1}}}$
Sustituimos los valores:
$\displaystyle {{P}_{2}}=\frac{\left( 12.0atm \right)\left( 373K \right)}{300K}=14.92atm$
Respuesta:
La presión interna del gas aumentará a 14.92 atm.
Si quieres conocer otros artículos parecidos a Problemas de Boyle-Mariotte puedes visitar la categoría Pensamiento Científico.
-
que pasa cunado tenemos todos los datos k hago por ejemplo:comprimir 100 litros de helio que se encuentra a una presion 2 atmosferas, mediante la utilizacion de un bomba que lo introducira en un tanque de 20 litros a una presion de 9 atmosferas.cabra en su totalidad el gas
-
Ola amm kasi no entiendo de eso xD pero es necesario aprender para la esku jeje..
Graxias, la solucion de problemas no es mi fuerte pero aki maso entendi ...
ok me voy
salu2-
si esta un poco difícil pero escuestion de aprender
-
-
que mal esplicas men en el segundo ejecicio dice la respuesta en miligramos de mercurio entoncs seria asii
1 atm = 760(mm Hg)
1.25 atm = XX= 760 * 1.25
X= 950 (mm Hg)Entoncs l presion en el recipiente de 3litros expresado en (mm Hg) sera de 950
SOLUCIONADOO!!!
-
me ha servido muchisimo, gracias mañana tengo el examen solo me falta aprobar, cuelga la de gay lussac, y charles. Besos
-
Illo payaso, que vas de listo diciendo que está mal explicado y el primero en confundir las medidas eres tú. No existen como medida de presión los miligramos de mercurio(mg Hg), existe los MILIMETROS de mercurio...(mm Hg). Soy licenciado en la Universidad MHAMCS23 (Mis Huevos en Almíbar y Mis Cojones Suman 23). Un besi guapi y pídele a los reyes una RAE
-
eee bajale dos bajale
-
-
Si tienes razón el resultado de la dos es : 950.15 mm Hg.
-
-
Mi buen Pumershyo.
Eso ya es de la habilidad del alumno o del aprendiz, yo no te voy a solucionar la vida, bienvenido a la ciencia.
Saludos
-
como resuelvo este problema :
en un laboratorio se obtiene 30 cm3 de nitrogeno a 18 oC y 750 mm de hg de presion , se decea saber cual es el volumen normal -
todo eso ya lo sabia pero es mejor seguir practicando
-
ests repuesta del problema 2 sta mal !!! seriAa
1 atm = 760(mm Hg)
1.25 atm = XX= 760 * 1.25
X= 950 (mm Hg)y entonces presion del recipiente de 3 litros expresado en (mm Hg) sera de 950
-
Claro, pero aclaro que en ningún momento la respuesta está mal, que responde otro aspecto que lo que pide el problema sí, pero no lo contrario ok.
lo que hacemos es convertir, eso es lo más fácil del mundo.
saludos y gracias por comentar.
-
Problemas muy Basicos para entender la Formula.Muy Bien.
-
Bien gracias,pero tengo una breve consultita
simpre queda P1.V1/P2 o V2????????
Me gustaron los problemos sería bueno que respondas.
Bye -
Hola amigo, No siempre, es depende de lo que te pida el problema.
Por ejemplo
P1 V1 = P2 V2
De ahi es dónde despejas todo, por ejemplo me piden el volumen final entonces es
V2 = P1V1/P2
así sucesivamente si sigues teniendo problemas, avísame.
-
como resuelvo este problema:
un gas ocupa un volumen de 350 litros a 20 grados centigrados bajop una prtecion constante cual sera su volumen a 78 grados centigrados -
Haz tu regla de tres para ese tipo de casos, piénsale mi querido amigo.
-
Grande carlos! Sos el mejor profesor 😀
-
jenial tio
-
como se transforman de mm de Hg a Atm?
-
un gas ocupa un volumen de 720 cc a una 1 atm y a 15º c cual sera su volumen a 3 atm, teniendo en cuanta q la temperatura es constante ¿¿¿como hay q resolverlo???
-
quiero saber cual sera el volumen si la presion aumenta a uno a ocho atmosferas
-
no se, espero que te ayude
-
-
Como ago para encontrar la presion si no la tengo
-
a presion de 15200 mmhg .15L de un gas a temperatura constante experimenta un cambio ocupando un volumen de 5 L ¿cual será la presión que ejerce? (antes de realizar el ejercicio exprese la presión en atmosfera)
Ayudaa pliss -
me ayudo
-
El problema 2 está erróneo, debido a que la presión que nos está pidiendo es en mmHg, y la respuesta nos la ofrecen en atm, por lo tanto confunde y enseña un error, fuera de eso está bien, saludos. 😀
29 Deja tu comentario
Deja una respuesta

Estos temas te pueden interesar